日本でもとうとう薬価がつきました。世界最高金額の医薬品「ゾルゲンスマ®(Zolgensma)」一般名はオナセムノゲン アベパルボベク(onasemnogene abeparvovec)。
日本でのお値段167,077,222円(約1.67億円)。アメリカでのお値段は約2.3億円()です。この薬が対象としているのは、脊髄性筋萎縮症という難病で、寿命も短くなる致死性の病です。
この金額はどのように算出されているのでしょうか。今回も変わらずICER-reviewの評価をベースに解説します。
現在、脊髄性筋萎縮症の薬剤といして承認されているのは2製品。Biogen社のSpinraza®(nusinersen)とNovartis社のZolgensma®です。この2製品のおおまかな違いとして挙げられるのは、
Spinraza:発症前~発症後の患者が対象。4か月毎に髄腔内に投与
Zolgensma:発症前の患者が主な対象、1度きり、で静脈内に投与
かと思います。
では、細かいデータを各社の臨床試験データから紐解いていきましょう。まずはInfantile-Onset(Type I)のSMAの臨床試験から。Biogenは下記に示すRCT臨床試験を行っており、Type I、Type II/III、の患者さんを対象にしていることが分かります。他方、Novartisは、Type Iの患者さんを対象にしています。Biogen社はプラセボコントロールに対し、Novartis社はオープンラベルシングルアーム。
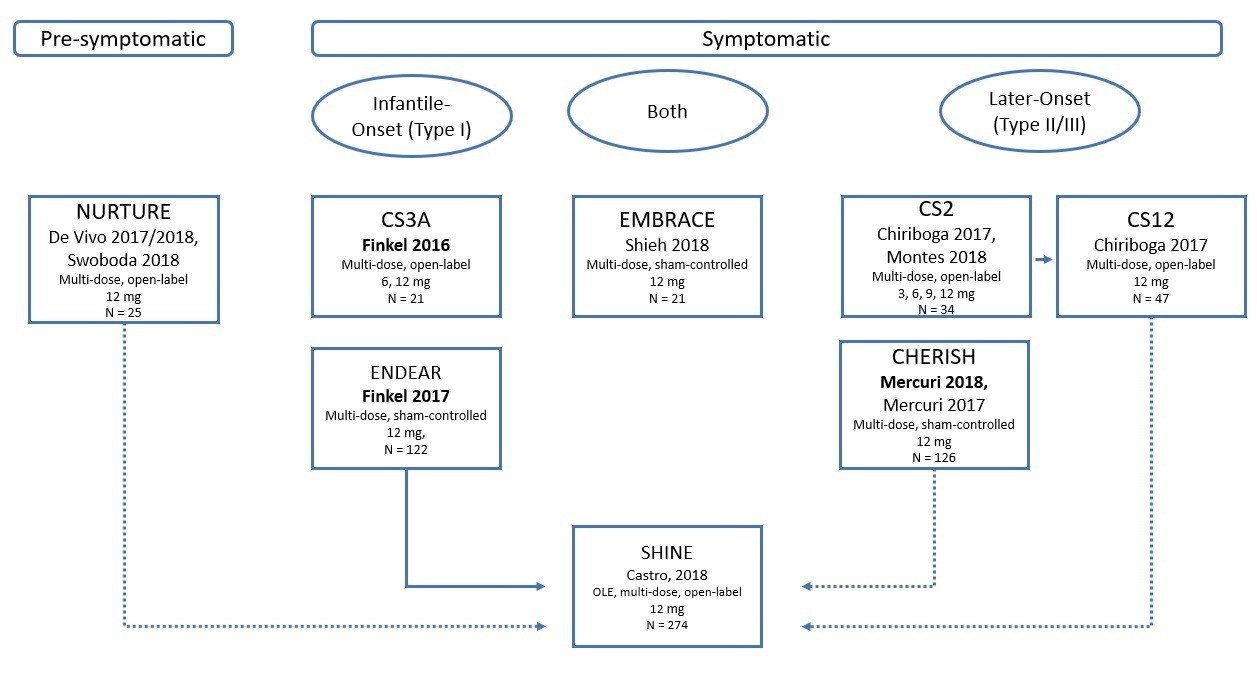
最初にSpinrazaとZolgensmaの基本情報の比較です。どちらの臨床試験においても、生まれてから2か月程度で病気が発症し、治療を開始したのは3-5か月後です。
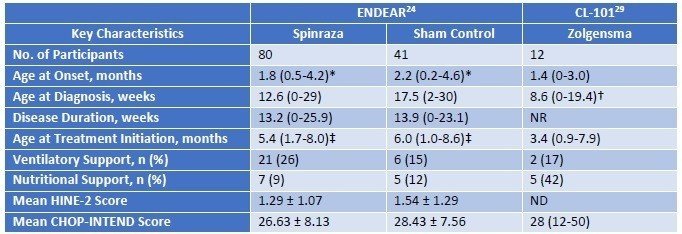
結果です。本文中からの引用ですが、ENDEARでは、Sham群の患者さんの平均余命が22週間(約半年)であった一方、Spinrazaでは73週間と大幅に延命できています。Zolgensmaにおいては、すべての患者さんで投与から2年間(108週間)以上の生存が確認されています。また、機能面においては、Sham群では頭を動かしたりできる患者さんがゼロなのに対して、SpinrazaやZolgensmaでは座ったり立ったりするほどまで回復する患者さんが認められます。このことからも、これらの医薬品には意味があることが示されます。
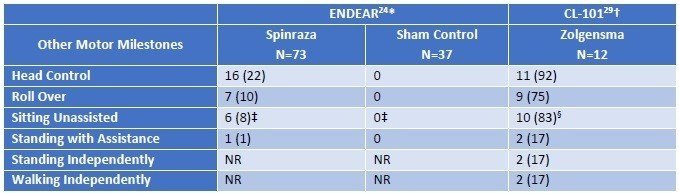
次にLater-Onset(Type II/III)のSMAに対する臨床試験結果です。こちらはZolgensmaのデータはなく、Spinrazaのみです。(試験名:CHERISH)。投与群で3ポイント以上の改善があることから、意義があるという結論となっています。
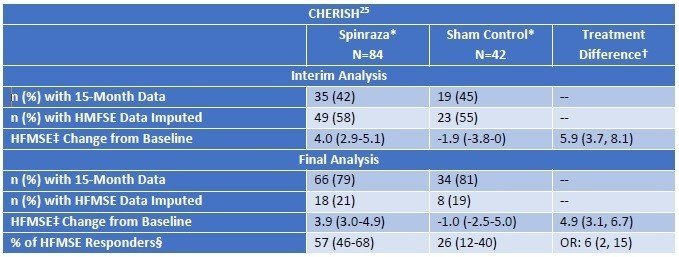
表で示されている指標はHFMSEというもので、Spinrazaのウェブサイトでも紹介されています。https://www.spinraza.jp/ja-jp/homepage/resources/HFMSE.html
両治療薬に関する懸念点としては、長期間の投与実績がないので、登記投与の場合の安全性について、Zolgensmaはシングルアーム試験でかつ12例の投与症例数しかなく、ヒストリカルコントロールと比較する場合に効果が強調されることや統計上有効と判断するためのサンプルサイズが小さい、との内容です。歴史的にはSMA患者さんは2歳で死亡するといわれておりますが、最近は人工呼吸器や栄養学的なサポートにより、現時点では2歳時点での死亡率は30%となっています。Zolgensma投与群においては、すべての患者で2歳までは生存が確認され、かつ人工呼吸器を装着していない、ということから有効性が示唆されますが、やはり対照群は必要、という見解です。
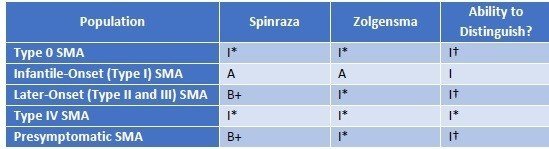
下記表において、どの患者さんにどの薬剤が有効か、ということに対して示されています。ZolgensmaはType I SMAのみ有効、SpinrazaはType I、Type II/IIIに有効、という結論です。有効性からもZolgensmaは適応年齢を2歳以下と限定している点がSpinrazaと異なります。
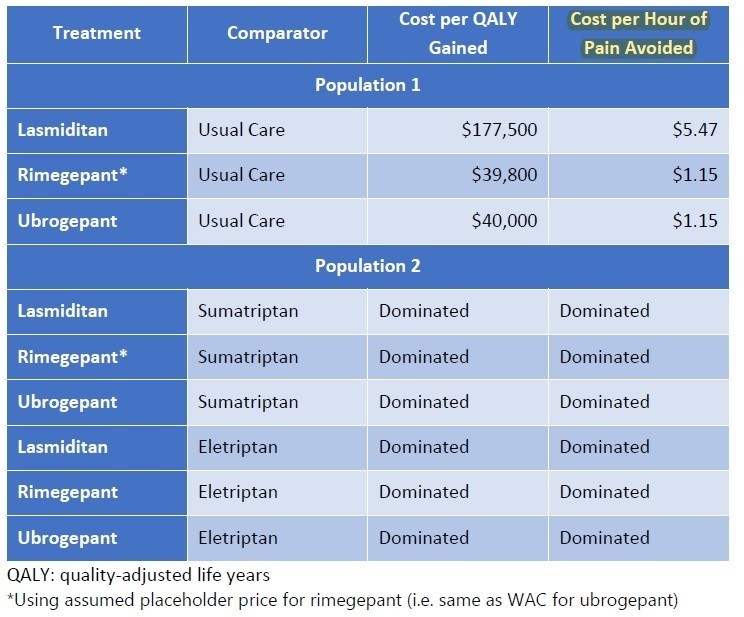
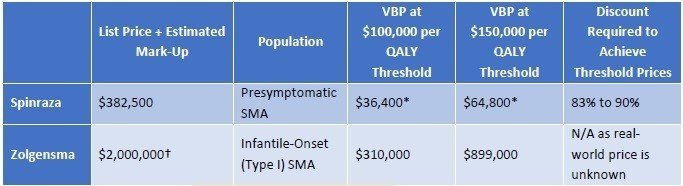
さて、気になるお値段の計算です。Type I SMAについて、SpinrazaとZolgensmaが比較されています。ICERの評価では、得ることができるQALYはZolgensmaの方が高いことが分かります。生存年もZolgensmaはSpinrazaの倍以上の延命効果があることが示されています。使用した金額はSpinrazaが2.23百万ドル、Zolgensmaが2百万ドル(どちらも約2億円強)
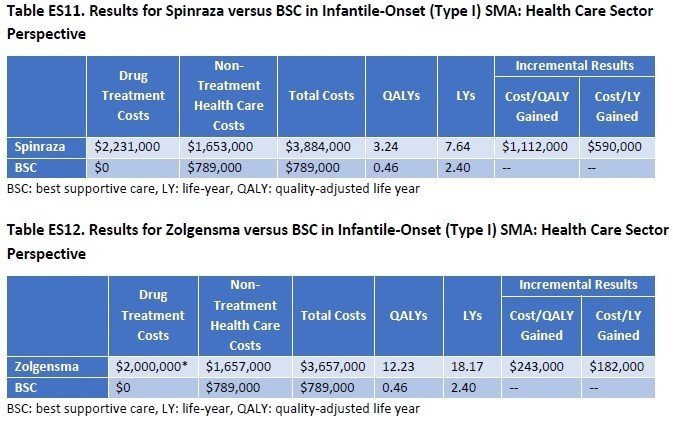
しかしながら、どちらの治療においてもQALYあたりのコストはICERが許容する15万ドル/QALYを超過した結果となっています。
Type II/IIIについては、Spinrazaのみの評価ですが、延命効果はほとんど期待できず、QALYがかすかに増加する、という結果です。この結果だけみるとBiogenの担当者は到底納得できない結果になるでしょうね。
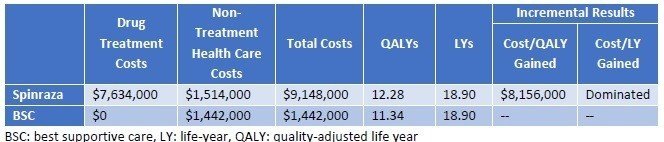
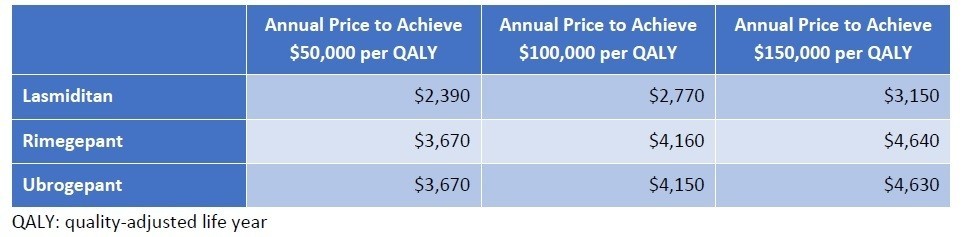
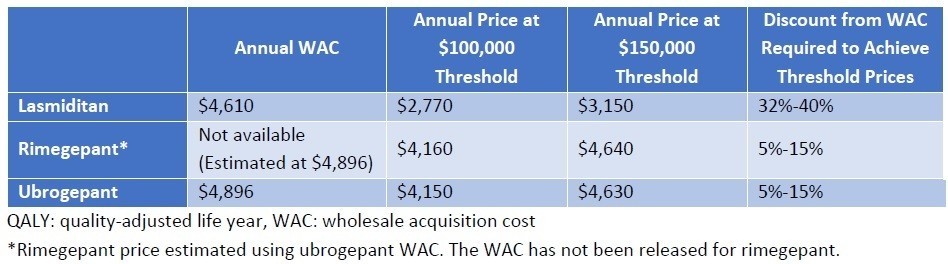
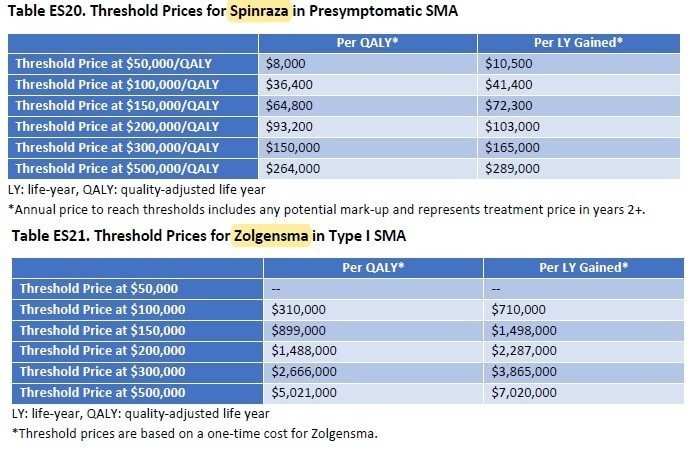
QALYあたり15万ドルを超えることになってしまいましたが、どのように落としどころを付けるのでしょうか。結論からいうと、SMAのような超希少疾患については、15万ドル/QALY以上の閾値をもうける、ということです。左に記載のメーカー希望小売価格に対して、15万ドル/QALYで計算すると、それぞれ64,800ドル、899,000ドルとなり、Spinrazaに至っては希望価格の8割引きとコメントされてしまっています(希望価格は38.25万ドル)。
そこで、ICERとしては、5万ドル~50万ドル/QALYでの分析をそれぞれの医薬品で評価を行い、価格設定を正当化しているようです。
Biogenの担当役員からは、この解析結果が好ましくなかったようで、恨み節ともとれるパブリックコメントが巻末に記載されています。
驚くべきことに、Novartisは「製品価格、5億円」が適正な価値と述べていましたが、トランプ流の交渉なのか特に2億円という金額に落ち着き特にコメントはしていません。また、臨床試験サイズを小さくすませて承認を取得する、などなど個人的にはNovartis社に学ぶことはたくさんありそうです。
本noteは、https://icer-review.org/material/sma-final-evidence-report/からの引用です。